
um blog sobre produtos médicos, central de material e esterilização,bloco cirurgico
segunda-feira, 25 de novembro de 2013
quarta-feira, 6 de novembro de 2013
sábado, 26 de outubro de 2013
Acesse: Manual de Registro e Cadastramento de Materiais de Uso em Saúde
Acesse: Manual de Registro e Cadastramento de Materiais de Uso em Saúde

Já está disponível no site da Anvisa o “Manual de Registro e Cadastramento de Materiais de Uso em Saúde”. A publicação é resultado do acordo de Cooperação celebrado entre a Anvisa, a Agência Brasileira de Desenvolvimento Industrial (ABDI) e o Serviço Brasileiro de Apoio às Micro e Pequenas Empresas (Sebrae).
O objetivo do manual é melhorar o nível de informações prestadas para a regularização de materiais de uso em saúde no Sistema Nacional de Vigilância Sanitária. Isso deve permitir a melhoria das condições sanitárias de fabricação, comercialização e regularização de materiais de uso em saúde, além de fortalecer o desenvolvimento tecnológico e industrial do Brasil. O manual pode ser utilizado por profissionais da saúde e do setor de materiais de uso em saúde.
Imprensa/Anvisa
Certificação obrigatória para agulhas e seringas entra em vigor
Certificação obrigatória para agulhas e seringas entra em vigor
3 de julho de 2013

Já está em vigor a exigência de certificação do Inmetro para as agulhas e seringas comercializadas no país. O prazo para a adequação destes materiais terminou na última segunda-feira (1º/7). Os requisitos mínimos de identidade e qualidade destes produtos foram determinados pela Anvisa em 2011 com o objetivo de garantir padrões mínimos para produtos largamente utilizados na assistência à saúde em todo o país.
Apenas os produtos comercializados antes da data de vigência das normas podem ser comercializados e utilizados, respeitando as datas de validade de cada unidade. As normas que tratam da certificação de seringas e agulhas são as resoluções RDC nº 3 e nº 5, ambas de 2011. O prazo de vigência das duas resoluções havia sido prorrogado até o dia 30 de junho deste ano para garantir que não houvesse descontinuidade no fornecimento dos produtos.
De acordo com levantamento da Anvisa, já existem 18 fornecedores de agulhas e seringas certificados no Brasil, o que garante o abastecimento do mercado nacional dentro das novas regras. A certificação é feita em instituições participantes do Sistema Brasileiro de Avaliação da Conformidade, coordenado pelo Inmetro.EquiposOs equipos de uso único de transfusão, de infusão gravitacional e de infusão para uso com bomba de infusão também terão certificação obrigatória. Nestes casos, o prazo foi prorrogado por mais 180 dias, até 30 de dezembro de 2013. Isso porque o processo de avaliação laboratorial dos produtos é mais complexo e exige mais tempo das empresas produtoras. A área técnica da Anvisa está programando reuniões com as empresas do setor e com o próprio Inmetro para garantir que até o fim do ano os produtos do setor estejam certificados.
Apenas os produtos comercializados antes da data de vigência das normas podem ser comercializados e utilizados, respeitando as datas de validade de cada unidade. As normas que tratam da certificação de seringas e agulhas são as resoluções RDC nº 3 e nº 5, ambas de 2011. O prazo de vigência das duas resoluções havia sido prorrogado até o dia 30 de junho deste ano para garantir que não houvesse descontinuidade no fornecimento dos produtos.
De acordo com levantamento da Anvisa, já existem 18 fornecedores de agulhas e seringas certificados no Brasil, o que garante o abastecimento do mercado nacional dentro das novas regras. A certificação é feita em instituições participantes do Sistema Brasileiro de Avaliação da Conformidade, coordenado pelo Inmetro.EquiposOs equipos de uso único de transfusão, de infusão gravitacional e de infusão para uso com bomba de infusão também terão certificação obrigatória. Nestes casos, o prazo foi prorrogado por mais 180 dias, até 30 de dezembro de 2013. Isso porque o processo de avaliação laboratorial dos produtos é mais complexo e exige mais tempo das empresas produtoras. A área técnica da Anvisa está programando reuniões com as empresas do setor e com o próprio Inmetro para garantir que até o fim do ano os produtos do setor estejam certificados.
Imprensa/Anvisa
segunda-feira, 21 de outubro de 2013
sexta-feira, 11 de outubro de 2013
Gêmeos siameses se prepararam para cirurgia de separação no PE
Gêmeos siameses se prepararam para cirurgia de separação no PE
Saulo e David receberam expansores para forçar crescimento da pele
Do R7, com Fala Brasil

Meninos dividem o mesmo fígadoReprodução/Record
Os gêmeos siameses Saulo e Davi, que nasceram há cinco meses unidos pelo abdome, passaram por uma cirurgia para implantação de expansores, em Pernambuco. Eles seguem internados em recuperação.
De acordo com os médicos, o objetivo dos expansores é forçar o crescimento da pele. Assim, com a sobra de tecido será possível fechar a barriga de cada um deles após a separação.
Esse é o primeiro passo para a operação definitiva que irá separar os irmãos. A operação deve acontecer em três meses.
Além de estarem unidos pela região do abdome, eles dividem o mesmo fígado.
Experiência bem sucedida traz esperanças de tratar mal de Alzheimer
Experiência bem sucedida traz esperanças de tratar mal de Alzheimer
Composto químico conseguiu bloquear os danos cerebrais ocasionados pela doença


Cientistas afirmam que ainda estão longe de um medicamento
Cientistas anunciaram esta quinta-feira ter descoberto um composto químico que, em ratos de laboratório, bloqueia uma doença dos príons, o que poder representar uma nova possibilidade terapêutica para tratar doenças como o mal de Alzheimer e o Parkinson.
Estes resultados, obtidos por cientistas britânicos, ainda estão muito distantes de um possível desdobramento em humanos, mas podem representar uma nova estratégia contra doenças neurodegenerativas como o Alzheimer e o Parkinson, que partilham mecanismos comuns com as doenças dos príons.
Em artigo publicado na revista americana Science Translational Medicine, este composto químico, administrado a camundongos, conseguiu bloquear os danos cerebrais, ocasionados por uma doença de príons, implicando um mecanismo de defesa natural celular, relativizou a principal responsável desta pesquisa, realizada pela Universidade de Leicester, Giovanna Mallucci, visto que o composto químico em questão "tem efeitos colaterais graves".
— Nós ainda estamos longe de um medicamento utilizável no homem. Mas o fato de estabelecer que este mecanismo de ação pode ser usado para proteger a perda de células do cérebro (...) significa que há uma possibilidade real de desenvolver tratamentos combatendo esta vista contra as doenças de príons e as outras doenças neurodegenerativas.
Declarou o professor Mallucci à agência de notícias britânica Press Association. O composto conhecido com o nome do laboratório GSK2606414 (produzido pela firma farmacêutica britânica GlaxoSmithKline) foi testado com 29 camundongos infectados pelos príons que provocou as encefalopatias, entre as quais a síndrome de Creutzfeldt-Jakob.
Eles foram comparados a um grupo de camundongos cujo cérebro também foi infectado por príons e que não ingeriram o composto.
As cobaias que foram tratadas sete semanas após terem sido infectadas pelos príons não sofreram perda de memória em um teste que consistiu em reconhecer um objeto familiar (enquanto aqueles tratados nove semanas após a infecção demonstraram ter problemas de memória).
Exame no cérebro dos camundongos confirmou a tendência a apresentar danos cerebrais naqueles tratados sete semanas após a infecção por príons.
Em comentário em separado publicado pela revista americana, os especialistas de neurociência Wiep Scheper e Jeroen Hoozemans, da Universidade Livre de Amsterdã, consideram que esta pesquisa poderá abrir uma nova estratégia terapêutica.
Mas pedem prudência porque os camundongos são modelos limitados para as doenças do cérebro humano e também porque o composto químico utilizado tem efeitos colaterais no pâncreas, com o desenvolvimento de diabetes e a perda de peso.
Copyright AFP - Todos os direitos de reprodução e representação reservados
sexta-feira, 4 de outubro de 2013
Programa mais medico ou trafego de pessoas?
Programa mais medico ou trafego de pessoas?
O governo brasileiro, signatário do tratado das nações unidas
contra o trafego de pessoas decide importar médicos de Cuba e pagar aquela
ditadura o valor proposto a todos os outros profissionais.
Os médicos vindos de Cuba não têm direitos, pois devem
relatar a seus feitores todas as atividades extras que por ventura tenham
intenção de praticar.
Segundo consta, receberam aproximadamente a mesma
remuneração que receberiam se estivessem em seu país e o restante servira para
financiar a ditadura Castro que tanto encanta nossos governantes.
Isto posto, fico me perguntando, até que ponto estas pessoas
realmente desejavam estar aqui?
Deixaram suas famílias, suas vidas, seus amigos em busca de
que?
Será que a cultura Castrista é tão humanitária assim? Ou estariam
essas pessoas sendo obrigadas a servir aquela ditadura?
Acredito que estas duvidas devam ser levadas em conta e nós
devemos cobrar de nossas autoridades maiores esclarecimentos.
Hugo Barcelar e Araujo Filho
sábado, 28 de setembro de 2013
Farmacêuticos agora podem prescrever
Deu na VEJA
Medicamentos
Farmacêuticos agora podem prescrever alguns tipos de remédios
Resolução publicada pelo Conselho Federal de Farmácia permite que profissionais receitem medicamentos que não exigem prescrição médica

A partir de hoje, profissionais vão poder sugerir o uso de analgésicos, medicamentos tópicos e fitoterápicos (Thinkstock)
A partir desta quarta-feira, Dia Internacional do Farmacêutico, os profissionais da categoria poderão receitar medicamentos que não exigem prescrição médica. A resolução do Conselho Federal de Farmácia (CFF) foi publicada no Diário Oficial da União. Com a nova regulamentação, os farmacêuticos de todo o país vão poder receitar, por exemplo, analgésicos, medicamentos tópicos e fitoterápicos.
Para o presidente do Conselho Regional de Farmácia do Estado de São Paulo (CRF-SP), Pedro Menegasso, a medida vai formalizar o que já era um hábito. "As farmácias são obrigadas a ter um farmacêutico e esse auxílio já é dado informalmente", diz.
A regulamentação foi aprovada pelo CFF nove dias depois de o Congresso Nacional aprovar os vetos feitos por Dilma Rousseff à Lei do Ato Médico. A lei prevê que o ato de prescrever tratamentos não é exclusivo dos formados em Medicina.
Para o presidente do CRF-SP, no entanto, a aprovação das mudanças poucos dias depois da aprovação dos vetos ao Ato Médico foi coincidência. "A decisão de prescrever medicamentos que não exigem receita médica não entra na área dos médicos. Todo medicamento oferece riscos. O farmacêutico é o profissional que melhor pode orientar os pacientes, já que é nosso campo de estudo."
Para o primeiro-secretário do Conselho Federal de Medicina (CFM), Desiré Callegari, "a lei que regulamenta a profissão do farmacêutico não prevê o diagnóstico de doenças e a prescrição de tratamentos." O CFM deve se pronunciar oficialmente ainda nesta quarta-feira.
Para o presidente do Conselho Regional de Farmácia do Estado de São Paulo (CRF-SP), Pedro Menegasso, a medida vai formalizar o que já era um hábito. "As farmácias são obrigadas a ter um farmacêutico e esse auxílio já é dado informalmente", diz.
A regulamentação foi aprovada pelo CFF nove dias depois de o Congresso Nacional aprovar os vetos feitos por Dilma Rousseff à Lei do Ato Médico. A lei prevê que o ato de prescrever tratamentos não é exclusivo dos formados em Medicina.
Para o presidente do CRF-SP, no entanto, a aprovação das mudanças poucos dias depois da aprovação dos vetos ao Ato Médico foi coincidência. "A decisão de prescrever medicamentos que não exigem receita médica não entra na área dos médicos. Todo medicamento oferece riscos. O farmacêutico é o profissional que melhor pode orientar os pacientes, já que é nosso campo de estudo."
Para o primeiro-secretário do Conselho Federal de Medicina (CFM), Desiré Callegari, "a lei que regulamenta a profissão do farmacêutico não prevê o diagnóstico de doenças e a prescrição de tratamentos." O CFM deve se pronunciar oficialmente ainda nesta quarta-feira.
(Com Estadão Conteúdo)
sexta-feira, 27 de setembro de 2013
Programa mais medico
Programa mais Medico
O programa mais medico do governo federal, vem abordando apenas um dos aspectos da saúde da
população. O fato de por a disposição das comunidades mais pobres um medico
ajuda porem não resolve a falta de infra estrutura ,de produtos para atendimento
, de leitos etc.
Mais uma vez nós, que
pagamos a conta das propostas populistas e dos desmandos de um governo que visa
apenas sua promoção, ficamos calados. Apenas os órgãos de classe, que lutam
contra a maquina governamental, vem se colocando numa posição muitas vezes
distorcidas e antipáticas para nos defender.
Não sou contra a contratação de médicos para atender os
locais onde não há medico. Mas estes profissionais, a exemplos dos grandes
centros não encontraram nenhuma estrutura para promover tal atendimento digno e
provavelmente arcaram com a conta de um programa equivocado e imediatista.
Hugo Barcelar.
Noticias do R7
Vacina brasileira contra dengue começa a ser testada no País em outubro
Única dose pretende combater quatro tipos da doença já identificados no mundo
- Agência Brasil
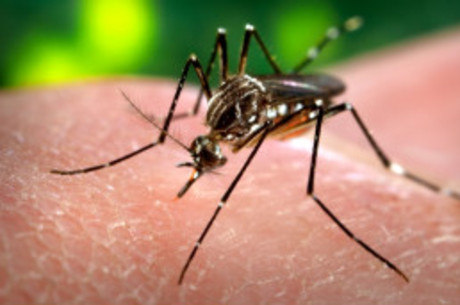
Durante o teste, voluntários tiveram dor e vermelhidão, sensação comum para vacinasAP
O Instituto Butantã, em parceria com a USP (Universidade de São Paulo), inicia em outubro os testes em seres humanos de uma vacina contra a dengue. A vacina está sendo desenvolvida para combater, em uma única dose, os quatro tipos da doença já identificados no mundo. Segundo Alexander Precioso, diretor de Ensaios Clínicos do Butantã, nenhum outro país tem uma vacina como essa.
A vacina começou a ser desenvolvida em 2006, juntamente com os institutos nacionais de Saúde dos Estados Unidos. Os vírus foram identificados no país norte-americano e, posteriormente, transferidos para o Butantã, em 2010. A técnica utiliza o chamado vírus atenuado.
— Isso ignifica que o próprio vírus da dengue é modificado para que seja capaz de fazer com que as pessoas produzam anticorpos, mas sem desenvolver a doença.
Uma empresa Pernambucana
Boa tarde
Gostaria de recomendar uma empresa genuinamente Pernambucana e inovadora.
http://www.medicalbrasil.com.br
Gostaria de recomendar uma empresa genuinamente Pernambucana e inovadora.
http://www.medicalbrasil.com.br
terça-feira, 24 de setembro de 2013
Resolução Nº 466/12
Desde 13 de junho de 2013, está em vigor no Brasil a Resolução Nº 466/12, do Conselho Nacional de Saúde (CNS), que aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos.
A resolução representa um grande avanço no desenvolvimento de pesquisas \o/
Leia o documento: http://bit.ly/1eEACZC
Obs.: Informação colhida na pagina da SOBECC nacional
sexta-feira, 20 de setembro de 2013
quinta-feira, 12 de setembro de 2013
quarta-feira, 4 de setembro de 2013
RESOLUÇÃO - RDC Nº 36,
RESOLUÇÃO - RDC Nº
36, DE 25 DE JULHO DE 2013
Institui ações para a segurança do paciente em serviços de
saúde e dá outras providências.
A Diretoria Colegiada da Agência Nacional de Vigilância
Sanitária, no uso das atribuições que lhe conferem os incisos III e IV, do art.
15 da Lei n.º 9.782, de 26 de janeiro de 1999, o inciso II, e §§ 1° e 3° do
art. 54 do Regimento Interno aprovado nos termos do Anexo I da Portaria nº 354
da ANVISA, de 11 de agosto de 2006, republicada no DOU de 21 de agosto de 2006,
e suas atualizações, tendo em vista o disposto nos incisos III, do art. 2º, III
e IV, do art. 7º da Lei n.º 9.782, de 1999, e o Programa de Melhoria do
Processo de Regulamentação da Agência, instituído por meio da Portaria nº 422,
de 16 de abril de 2008, em reunião realizada em 23 de julho de 2013, adota a
seguinte Resolução da Diretoria Colegiada e eu, Diretor-Presidente , determino
a sua publicação
CAPÍTULO I
DAS DISPOSIÇÕES
INICIAIS
Seção I
Objetivo
Art. 1º Esta Resolução tem por objetivo instituir ações para
a promoção da segurança do paciente e a
melhoria da qualidade nos serviços de saúde.
Seção II
Abrangência
Art. 2º Esta Resolução se
aplica aos serviços de saúde, sejam eles públicos, privados, filantrópicos,
civis ou militares, incluindo aqueles que exercem ações de ensino e pesquisa.
Parágrafo único. Excluem-se do escopo desta Resolução os
consultórios individualizados, laboratórios clínicos e os serviços móveis e de
atenção domiciliar.
Seção III
Definições
Art. 3º Para efeito desta Resolução são adotadas as
seguintes definições:
I - boas práticas de funcionamento do serviço de saúde:
componentes da garantia da qualidade que asseguram que os serviços são
ofertados com padrões de qualidade adequados;
II - cultura da segurança: conjunto de valores, atitudes,
competências e comportamentos que determinam o comprometimento com a gestão da
saúde e da segurança, substituindo a culpa e a punição pela oportunidade de
aprender com as falhas e melhorar a atenção à saúde;
III - dano: comprometimento da estrutura ou função do corpo
e/ou qualquer efeito dele oriundo, incluindo doenças, lesão, sofrimento, morte,
incapacidade ou disfunção, podendo, assim, ser físico, social ou psicológico;
IV - evento adverso: incidente que resulta em dano à saúde;
V - garantia da qualidade: totalidade das ações sistemáticas
necessárias para garantir que os serviços prestados estejam dentro dos padrões
de qualidade exigidos para os fins a que se propõem;
VI - gestão de risco: aplicação sistêmica e contínua de
políticas, procedimentos, condutas e recursos na identificação, análise,
avaliação, comunicação e controle de riscos e eventos adversos que afetam a
segurança, a saúde humana, a integridade profissional, o meio ambiente e a
imagem institucional;
VII - incidente: evento ou circunstância que poderia ter
resultado, ou resultou, em dano desnecessário à saúde;
VIII - núcleo de
segurança do paciente (NSP): instância do serviço de saúde criada para promover
e apoiar a implementação de ações voltadas à segurança do paciente;
IX - plano de segurança do paciente em serviços de saúde:
documento que aponta situações de risco e descreve as estratégias e ações
definidas pelo serviço de saúde para a gestão de risco visando a prevenção e a
mitigação dos incidentes, desde a admissão até a transferência, a alta ou o
óbito do paciente no serviço de saúde;
X - segurança do paciente: redução, a um mínimo aceitável,
do risco de dano desnecessário associado à atenção à saúde;
XI - serviço de saúde: estabelecimento destinado ao desenvolvimento
de ações relacionadas à promoção, proteção, manutenção e recuperação da saúde,
qualquer que seja o seu nível de complexidade, em regime de internação ou não,
incluindo a atenção realizada em consultórios, domicílios e unidades móveis;
XII - tecnologias em saúde: conjunto de equipamentos,
medicamentos, insumos e procedimentos utilizados na atenção à saúde, bem como
os processos de trabalho, a infraestrutura e a organização do serviço de saúde.
CAPÍTULO II
DAS CONDIÇÕES ORGANIZACIONAIS
Seção I
Da criação do Núcleo de Segurança do Paciente
Art. 4º A direção do serviço de saúde deve constituir o Núcleo de Segurança do Paciente (NSP)
e nomear a sua composição, conferindo aos membros autoridade, responsabilidade
e poder para executar as ações do Plano de Segurança do Paciente em Serviços de
Saúde.
§ 1º A direção do serviço de saúde pode utilizar a estrutura
de comitês, comissões, gerências, coordenações ou núcleos já existentes para o
desempenho das atribuições do NSP.
§ 2º No caso de
serviços públicos ambulatoriais pode ser constituído um NSP para cada serviço
de saúde ou um NSP para o conjunto desses, conforme decisão do gestor local do
SUS.
Art. 5º Para o
funcionamento sistemático e contínuo do NSP a direção do serviço de saúde deve
disponibilizar:
I - recursos humanos, financeiros, equipamentos, insumos e
materiais;
II - um profissional responsável pelo NSP com participação
nas instâncias deliberativas do serviço de saúde.
Art. 6º O NSP deve adotar os seguintes princípios e
diretrizes:
I - A melhoria contínua dos processos de cuidado e do uso de
tecnologias da saúde;
II - A disseminação sistemática da cultura de segurança;
III - A articulação e a integração dos processos de gestão
de risco;
IV - A garantia das boas práticas de funcionamento do
serviço de saúde.
Art.7º Compete ao NSP:
I - promover ações para a gestão de risco no serviço de
saúde;
II - desenvolver ações para a integração e a articulação
multiprofissional no serviço de saúde;
III - promover mecanismos para identificar e avaliar a
existência de não conformidades nos processos e procedimentos realizados e na
utilização de equipamentos, medicamentos e insumos propondo ações preventivas e
corretivas;
IV - elaborar,
implantar, divulgar e manter atualizado o Plano de Segurança do Paciente em
Serviços de Saúde;
V - acompanhar as ações vinculadas ao Plano de Segurança do
Paciente em Serviços de Saúde;
VI - implantar os Protocolos de Segurança do Paciente e
realizar o monitoramento dos seus indicadores;
VII - estabelecer barreiras para a prevenção de incidentes
nos serviços de saúde;
VIII - desenvolver, implantar e acompanhar programas de
capacitação em segurança do paciente e qualidade em serviços de saúde;
IX - analisar e avaliar os dados sobre incidentes e eventos
adversos decorrentes da prestação do serviço de saúde;
X - compartilhar e divulgar à direção e aos profissionais do
serviço de saúde os resultados da análise e avaliação dos dados sobre incidentes
e eventos adversos decorrentes da prestação do serviço de saúde;
XI - notificar ao Sistema Nacional de Vigilância Sanitária
os eventos adversos decorrentes da prestação do serviço de saúde;
XII- manter sob sua guarda e disponibilizar à autoridade
sanitária, quando requisitado, as notificações de eventos adversos;
XIII - acompanhar os alertas sanitários e outras
comunicações de risco divulgadas pelas autoridades sanitárias.
Seção II
Do Plano de Segurança do Paciente em Serviços de Saúde
Art. 8º O Plano de Segurança do Paciente em Serviços de
Saúde (PSP), elaborado pelo NSP, deve estabelecer estratégias e ações de gestão
de risco, conforme as atividades desenvolvidas pelo serviço de saúde para:
I - identificação, análise, avaliação, monitoramento e
comunicação dos riscos no serviço de saúde, de forma sistemática;
II - integrar os diferentes processos de gestão de risco
desenvolvidos nos serviços de saúde;
III - implementação de protocolos estabelecidos pelo
Ministério da Saude;
IV - identificação do paciente;
V - higiene das mãos;
VI - segurança cirúrgica;
VII - segurança na prescrição, uso e administração de
medicamentos;
VIII - segurança na prescrição, uso e administração de
sangue e hemocomponentes;
IX - segurança no uso de equipamentos e materiais;
X - manter registro adequado do uso de órteses e próteses
quando este procedimento for realizado;
XI - prevenção de quedas dos pacientes;
XII - prevenção de úlceras por pressão;
XIII - prevenção e controle de eventos adversos em serviços
de saúde, incluindo as infecções relacionadas à assistência à saúde;
XIV- segurança nas terapias nutricionais enteral e
parenteral;
XV - comunicação efetiva entre profissionais do serviço de
saúde e entre serviços de saúde;
XVI - estimular a participação do paciente e dos familiares
na assistência prestada.
XVII - promoção do ambiente seguro
CAPÍTULO III
DA VIGILÂNCIA, DO MONITORAMENTO E DA NOTIFICAÇÃO DE EVENTOS ADVERSOS
Art. 9º O monitoramento dos incidentes e eventos adversos
será realizado pelo Núcleo de Segurança do Paciente - NSP.
Art. 10 A notificação dos eventos adversos, para fins desta
Resolução, deve ser realizada mensalmente pelo NSP, até o 15º (décimo quinto)
dia útil do mês subsequente ao mês de vigilância, por meio das ferramentas
eletrônicas disponibilizadas pela Anvisa.
Parágrafo único - Os eventos adversos que evoluírem para
óbito devem ser notificados em até 72 (setenta e duas) horas a partir do
ocorrido.
Art. 11 Compete à ANVISA, em articulação com o Sistema
Nacional de Vigilância Sanitária:
I - monitorar os dados sobre eventos adversos notificados
pelos serviços de saúde;
II - divulgar relatório anual sobre eventos adversos com a
análise das notificações realizadas pelos serviços de saúde;
III - acompanhar, junto às vigilâncias sanitárias distrital,
estadual e municipal as investigações sobre os eventos adversos que evoluíram
para óbito.
CAPÍTULO IV
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
Art. 12 Os serviços de saúde abrangidos por esta Resolução
terão o prazo de 120 (cento e vinte) dias para a estruturação dos NSP e
elaboração do PSP e o prazo de 150 (cento e cinquenta) dias para iniciar a
notificação mensal dos eventos adversos, contados a partir da data da
publicação desta Resolução.
Art. 13 O descumprimento das disposições contidas nesta
Resolução constitui infração sanitária, nos termos da Lei n. 6.437, de 20 de
agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e
penal cabíveis.
Art. 14 Esta
Resolução entra em vigor na data de sua publicação.
terça-feira, 3 de setembro de 2013
ENZIMAS
ENZIMAS
Enzimas são substâncias naturais
envolvidas em todos os processos bioquímicos que ocorrem nas células vivas. São
proteínas e, portanto, consistem em cadeias de aminoácidos unidas por ligações
peptídicas. Servem para catalisar reações bioquímicas, o que significa que
aumentam a velocidade da reação bioquímica sem se deixar afetar pela reação
propriamente dita.
São capazes de decompor moléculas
complexas em unidades menores (carboidratos em açúcares, por exemplo). Algumas
das enzimas mais conhecidas se encontram em nosso trato digestivo, onde
auxiliam a digestão e a assimilação de alimentos.
Uma das características principais das
enzimas é que elas têm uma e apenas uma função cada (especificidade).
Cada substancia possui apenas sua única enzima respectiva. O substrato que será
transformado preenche a enzima como chave-fechadura. Apenas quando a enzima
ideal encontrar o substrato ideal, as reações bioquímicas podem ocorrer.
Atuação das Enzimas
As enzimas se conectam as substâncias
reagentes e enfraquecem certas ligações químicas, de modo que menos energia é
necessária para que as reações ocorram.
Quando as enzimas são aquecidas, elas
aceleram ainda mais as reações, mas apenas até certo ponto a partir do qual
elas se modificam e perdem suas propriedades catalisadoras.
As enzimas têm a
capacidade de agir sobre o sangue, gordura, muco, saliva, proteínas em geral,
produzindo um substrato mais fácil de ser removido pelos agentes de limpeza,
tornando mais efetiva a ação dos mesmos.
ENZIMAS EM PRODUTOS DE LIMPEZA
Vantagens da Utilização de Enzimas:
Os maiores problemas do detergente
comum são:
Atuação prioritária
sobre gorduras e óleos; as proteínas e açúcares são fracamente afetados pela
atividade dos íons livres;
Ação lenta sobre a
matéria orgânica, tornando necessária a escovação, o que resulta em risco para
o funcionário que manuseia os materiais contaminados durante a limpeza
mecânica;
Os íons livres, que
propiciam a eliminação das sujidades (restos orgânicos), também atacam o
material de fabricação dos instrumentos e equipamentos. Os detergentes comuns
não possuem atividade específica sobre as impurezas orgânicas. Seu uso
constante provoca desgaste, abrasão e corrosão nos materiais clínicos, que
poderão finalmente quebrar-se.
Os detergentes
modernos apresentam um espectro de ação e de utilização bastante amplo,
havendo, consequentemente, necessidade de especialização das formulações. A
principal vantagem da formulação de detergentes que contenha enzimas é a
substituição de produtos cáusticos, ácidos e solventes tóxicos, que agridem o
meio ambiente e que provocam o desgaste de materiais e de instrumentos. O uso
diversificado das enzimas deve-se à sua característica de atuar como
biocatalisadores especializados. As enzimas adicionadas às formulações de
detergentes de uso hospitalar, e industrial agem digerindo e dissolvendo
resíduos orgânicos (sangue, fezes, urina, vômitos, manchas diversas),
higienizando as partes externas e internas de instrumentos cirúrgicos,
desobstruindo canais com resíduos e coagulados, eliminando resíduos fecais dos
canais e superfícies dos fibroscópios e removendo contaminantes da rouparia
hospitalar (Godfrey, 1996).
Os principais tipos
de enzimas utilizadas nessa indústria incluem:
Principais Enzimas envolvidas na
fabricação de detergentes:
Amilase decomposição do
amido outros glicídios de carboidratos
Lípase decomposição de lipídios
Protease decomposição de
proteínas
Peptidase decomposição de
peptídicos em aminoácidos
Carbohidrase decomposição de
carboidrato
A preocupação crescente com o ambiente
é outro fator que tem levado os fabricantes a reavaliar as formulações já
existentes. Nas formulações mais recentemente utilizadas, muitos ingredientes
impróprios, até então empregados, foram substituídos por enzimas, mantendo o
mesmo desempenho dos antigos produtos. As enzimas como princípios ativos dos
detergentes apresentam a grande vantagem de ser 100% biodegradáveis.
Uma nova geração de detergentes sem
fosfato e sem cloro alvejante, contendo apenas uma mistura de enzimas, com formulação
mais segura e menos cáustica, foi introduzida na Europa há vários anos. O uso
de enzimas, em particular as amilases, em processos industriais, satisfaz as
exigências das normas de ISO 14000 de baixo impacto ambiental, além da redução
de gastos energéticos associados ao aumento da qualidade do produto.
Principais Tipos de Enzimas Componentes
de Produtos de Limpeza:
Proteases: As proteases podem
atuar sobre manchas que contém proteína, hidrolisando parcialmente e aumentando
assim sua solubilidade em água.
- A grande maioria das proteases
de uso comercial é atualmente produzida por variadas espécies de Bacillus sp.
(bactéria) em sistemas de fermentação submersa.
As proteases de uso comercial em detergentes
possuem pH ótimo de ação alcalino e usualmente resistem a elevadas temperaturas
o que permite o uso dos detergentes em sistemas de lavagem a quente.
Lípases: As lípases podem atuar sobre manchas
que contém gorduras (lipídeos e/ou triglicerídeos) e os transformar em
substâncias mais solúveis em água.
- Os materiais graxos que formam
manchas em sua maioria são triglicerídeos, que pela ação das lípases são
convertidos em ácidos graxos livres e di-, mono- glicerídeos e glicerol. A ação
das lípases libera os ácidos que em pH alcalino formam os carboxilatos que são
solúveis em água.
Amilases: As amilases
atuam sobre manchas que contém amido. O amido contido nesses materiais
usualmente atua como uma cola que retém, inclusive, manchas de origens proteicas
e lipídicas.
- As amilases comercializadas
atualmente são produzidas por Bacilus licheniformis e B.
amyloliquefaciens por fermentação submersa. Essas enzimas hidrolisam
amido transformando-o em oligômeros de cadeia curta (gelatinização) que são
solúveis em água. Como outras enzimas usadas em detergentes, possuem
resistência moderada a pH alcalino e atuam em temperaturas elevadas.
quinta-feira, 29 de agosto de 2013
terça-feira, 27 de agosto de 2013
09 CLASSIFICAÇÃO DE PRODUTOS
09 CLASSIFICAÇÃO DE PRODUTOS
ABAIXADOR
DE LINGUA DE MADEIRA
ESPECIFICAÇÃO
|
ABAIXADOR DE LINGUA DE MADEIRA
|
CLASSIFICAÇÃO:
|
Produto
descartável, classe III, não estéril,
não invasivo, atoxico, uso único, com registro de isenção obrigatório no M.S.
|
VALIDADE:
|
3
a 5 anos
|
DESCRIÇÃO:
|
Espátula
de madeira descartável formato convencional
com extremidade arredondada, com 14cm de comprimento, 1,4cm de largura
e 0,2cm de espessura, embalagem com dados de identificação nº de lote e
validade, contendo 100 unidades.
|
UTILIZAÇÃO:
|
Produto
próprio para facilitar o exame da cavidade oral e anexos
|
APRESENTAÇÃO:
|
PACOTE CONTENDO 100 UNIDADES
|
PRINCIPAIS
FABRICANTES:
|
Theoto
|
ESPECIFICAÇÕES
EM LICITAÇÃO
|
ABAIXADOR DE LÍNGUA DE MADEIRA descartável, de uso
único,. Embalagem em pacote com 100 und, contendo dados de identificação,
procedência, lote, validade, e registro de isenção no MS Apresentação: pacote com 100
unidades.
|
AGULHA DESCARTÁVEL
ESPECIFICAÇÃO
|
Agulha
hipodérmica, descartável,estéril,
|
|
CLASSIFICAÇÃO:
|
Produto
invasivo, estéril, classe I, uso único, com registro obrigatório no
Ministério da Saúde.
|
|
VALIDADE:
|
3
a 5 anos.
|
|
DESCRIÇÃO:
|
Produto
próprio para romper as barreiras físicas como: pele, músculo e paredes de
vasos, de forma a introduzir ou coletar substâncias líquidas (sangue,
medicamentos, etc.), composto de:
|
|
CÃNULA-
|
tubo
em aço inoxidável, de formato cilíndrico, reto, oco, centrado ao longo do
eixo central longitudinal do canhão, lubrificada com silicone de pureza
farmacêutica, isenta de rebarba, possui o lumem limpo.
|
|
BISEL.
|
corte
transversal e trifacetado, perfeitamente afiado, livre de
defeitos prejudiciais a sua finalidade de promover a
quebra das
barreiras
físicas, localizado na extremidade distal da Cânula,
|
|
PROTETOR
|
tubo
plástico apropriado para proteger a Cânula e o Bisel, lubrificado
externamente a banho de silicone.com calibre variado.
|
|
CANHÃO-
|
parte
plástica, atóxica, em propileno, com 6% de conicidade em seu interior, proporcionando perfeito encaixe,
responsável pela ligação entre a cânula
e a seringa, que se localiza na extremidade proximal da cânula.
|
|
UTILIZAÇÃO:
|
Produto
normalmente utilizado para vacinações, administração de
medicamentos
seja por via IV, IM, ID, e SC, para punção de sangue ou líquidos intra-
corpóreo tanto em ambiente hospitalar como fora deste.
|
|
APRESENTAÇÃO:
|
Produto
apresenta-se, embalado individualmente, em papel grau
cirúrgico
ou filme termoplástico, e é referenciada, em milímetros (mm), pelo
comprimento e calibre da cânula que o
compõe.
Por
exemplo: 13 x 0,38; 25 x 0,7 (embora leia-se 25 x 7,13x4, etc ) , sua embalagem
deve obedecer as exigências legais.
|
|
PRINCIPAIS
FABRICANTES:
|
Bectron
Dickson Industria e Comércio (BD);
Laboratório
B.Braun Ltda. ;
SR;
Plascalp
|
|
ESPECIFICAÇÕES
EM LICITAÇÃO
|
Agulha
hipodérmica descartável, de uso único, bisel trifacetado, parede fina siliconização externa, com protetor. Embalagem
tipo blister individual em papel grau
cirúrgico, contendo dados de identificação, procedência, lote, validade, tipo
de esterilização e registro no MS
Apresentação:
unidade.
|
|
AGULHA DE FISTULA
ESPECIFICAÇÃO
|
Agulha de acesso a Agulha Fistula Arterial
ou Venosa de uso único e estéril, com
calibre variado.
|
|
CLASIFICAÇÃO:
|
Produto invasivo estéril de classe I , com
registro obrigatório no M S.
|
|
VALIDADE:
|
3
a 5 anos.
|
|
DESCRIÇÃO:
|
Produto próprio para romper as barreiras
físicas como pele e paredes de vasos, de forma a permitir o acesso a Fistula
Arterial ou Venosa composto de:
|
|
CONECTOR
|
trata-se de um adaptador com Luer fêmea e
tampa,
responsávelpela ligação do conjunto (Agulha
de Fistula) a linha arterial venosa,
localizado na parte distal..
|
|
TUBO EXTENSOR
|
trata-se de um tubo flexível, transparente
com cumprimento variável entre 240 e
310 mm, responsável pela ligação entre
o Conector e a Asa de Fixação
|
|
CLAMP DE CORTE
|
trata-se de uma pinça de estrangulamento do
tubo, que tem como função a
interrupção do fluxo
|
|
ASA DE FIXAÇÃO
|
trata-se de uma asa plástica em forma
de borboleta
que permite a empunhadura e a fixação da agulha
propriamente dita.
|
|
CÃNULA:
|
tubo em aço inoxidável, de formato cilíndrico,
reto, oco,
centrado ao longodo eixo central
longitudinal do canhão lubrificada com silicone de pureza farmacêutica,isenta
de rebarba, possui o lumem limpo.
|
|
BISEL
|
corte transversal e trifacetado,
perfeitamente afiado, livre de defeitos prejudiciais a sua finalidade de
promover a quebra das barreiras físicas, localizado na extremidade distal da
Cânula,
|
|
PROTETOR
|
tubo plástico apropriado para proteger a
Cânula e o Bisel, lubrificado externamente a banho de silicone
|
|
UTILIZAÇÃO:
|
Produto utilizado em sessões de hemodiálise
para permitir o acesso a Fistula Arterial
ou Venosa, possibilitando a ligação do paciente a maquina de
hemodiálise.
|
|
APRESENTAÇÃO:
|
Produto apresenta-se, embalado
individualmente, em papel grau cirúrgico ou filme termoplástico, e é referenciada,
pelo seu calibre de 16 ou 17G sua embalagem deve obedecer as exigências
legais.
|
|
PRINCIPAIS FABRICANTES:
|
Becton Dickson Indústria e Comércio (BD);
Laboratório B. Braun Ltda. ;
|
|
ESPECIFICAÇÕES EM LICITAÇÃO
|
Agulha de acesso a Agulha Fistula Arterial
ou Venosa,
descartável
de uso único e estéril, com calibre variado., em aço inoxidavel, siliconizada
, de parede super fina,com bisel back-eye, com asas e travas clamp, conector
luer lock, embalagem individual constituida de filme e papel grau cirurgico,com dados de identificação e
procedência, lote, data de fabricação, validade e reg. no ms.
|
|
AGULHA ESPECIAIS
Agulha para
anestesia Raquidiana
ESPECIFICAÇÃO
|
Agulha
para anestesia Raquidiana
|
|
CLASIFICAÇÃO:
|
Produto
invasivo, estéril, classe I, uso único, descartavel com registro obrigatório
no Ministério da Saúde.
|
|
VALIDADE:
|
3
a 5 anos
|
|
DESCRIÇÃO:
|
Produto
próprio para romper as barreiras físicas como pele e paredes de vasos, de
forma a permitir anestesia raquidiana composto de:
|
|
Canula
|
tubo
em aço inoxidável, de formato cilíndrico, reto, oco,centrado ao longodo
eixo
central longitudinal do canhão lubrificada com silicone de pureza farmacêutica,isenta
de rebarba, possui o lumem limpo.
|
|
bisel
tipo Quincke
|
Sem
imperfeições ou rebarbas previne a dilaceração dos tecidos
|
|
mandril
|
de
encaixe anatômico
|
|
canhão transparente
|
Luer
Lok transparente , atóxico, em propileno,
com 6% de conicidade em seu interior,
proporcionando perfeito encaixe,
responsável pela ligação
entre
a cânula e a seringa,
localizada na extremidade proximal da cânula
|
|
empunhadura
anatômica com depressões digitais
Codificação
em cores:
|
||
UTILIZAÇÃO:
|
Bloco
cirúrgico por especialista indicada
para anestesia raquidiana ou coleta de liquor e liquido aminiotico para exame
laboratorial
|
|
APRESENTAÇÃO:
|
Blister
individual estéril de calibres entre 18G a 29G e tamanhos entre 1e 7
polegadas
|
|
PRINCIPAIS
FABRICANTES:
|
Laboratório
B.Braun / BD
/ Portex
|
|
ESPECIFICAÇÕES
EM LICITAÇÃO
|
Agulha para anestesia
raque, descartável, bisel tipo QUINCHE, mandril de encaixe anatômico, canhão
transparente empunhadura anatômica com depressões digitais. Agulha G 25 e G
26 (0,50 x 88 mm). G27X88
mm Estéril.
Embalagem individual, em papel grau cirúrgico, constando identificação e procedência,
data e tipo da esterilização, tempo de validade e registro em órgão
competente
|
|
Agulha para
anestesia Peridural
ESPECIFICAÇÃO
|
Agulha para anestesia peridural, epidural
ou caudal descartável, uso único,
estéril, embalagem individual, papel grau cirúrgico.
|
|
CLASIFICAÇÃO:
|
Produto invasivo, estéril, classe I, uso
único, descartavel com registro obrigatório no Ministério da Saúde.
|
|
VALIDADE:
|
3 a 5 anos
|
|
DESCRIÇÃO:
|
Produto
próprio para romper as barreiras físicas como pele e paredes de vasos,
de forma a permitir o acesso a anestesia composto de: Agulha para anestesia
peridural, composta de ,
|
|
Canula
|
tubo
em aço inoxidável, de formato cilíndrico, reto, oco,centrado ao longodo eixo
central longitudinal do canhão lubrificada com silicone de pureza farmacêutica,isenta
de rebarba, possui o lumem limpo. marcação em centímetro
para controle de profundidade,
|
|
bisel tipo TUOHY
|
Bisel
curvo calcanhar sego reduzindo risco de punção acidental da duramáter
|
|
mandril
|
empunhadura
anatômica, canhão transparente.
|
|
canhão
transparente
|
Cônico facilita inserção de cateteres
|
|
UTILIZAÇÃO:
|
Bloco cirúrgico por especialista
|
|
APRESENTAÇÃO:
|
Embalagem individual, blister rigido,
constando identificação e procedência, data e tipo da esterilização, tempo de
validade e registro em órgão competente nos calibres 16,17,18,20G, comprimento
8.1cm, ,
|
|
PRINCIPAIS FABRICANTES:
|
BD
B, BRAUN
PORTEX
|
|
ESPECIFICAÇÕES EM LICITAÇÃO
|
Agulha para anestesia peridural, epidural ou caudal, G18, bisel tipo Tuohy,
marcação em cm para controle de profundidade, comprimento 8.1cm, empunhadura
anatômica, canhão transparente, embalagem individual, blister rígido contendo informações sobre esterilização,
validade , lote e registro no MS
|
|
Assinar:
Comentários (Atom)





